Pautas heterólogas de vacunación frente a la COVID-19: Inmunogenicidad y seguridad
Autores:
Ana Fernández Dueñas.
Aurora Limia Sánchez.
Carmen Olmedo Lucerón.
Laura Sánchez-Cambronero Cejudo.
Sonia Fernández Conde.
Elena Cantero Gudino.
Área Programas de Vacunación. Subdirección General de Promoción de la Salud y Prevención. Dirección General de Salud Pública. Ministerio de Sanidad.
Este artículo de The Lancet presenta los resultados del estudio Com-COV2, llevado a cabo por la Universidad de Oxford, con el objetivo de estudiar la seguridad e inmunogenicidad de diferentes pautas heterólogas (administración de 2 vacunas diferentes) en la primovacunación frente a la COVID-19.
Los resultados de este ensayo clínico, confirman que las pautas heterólogas, mezclando vacunas de vector de adenovirus y de ARNm, son alternativas seguras a las pautas homólogas (misma vacuna), induciendo incluso mejor respuesta inmune que una pauta homóloga, tanto en respuesta humoral como respuesta celular.
La Estrategia de vacunación frente a COVID-19 en España ya incluye las pautas heterólogas para los diferentes grupos de población. En concreto, en la población de trabajadores esenciales menores de 60 años vacunados con Vaxzevria se recomienda la administración de Comirnaty para completar la pauta. Los resultados de este estudio Com-CoV2 corroboran lo observado en otros estudios sobre pauta heteróloga realizados en España (CombivacS)(1) y en otros países de nuestro entorno(2,3,4,5,6,7) reforzando las recomendaciones adoptadas dicha Estrategia.
Además, en la Estrategia en España, se recomienda pauta heteróloga en dosis de recuerdo: administrar una vacuna ARNm (0,3 ml Comirnaty o 0,25ml de Spikevax - la mitad de la dosis habitual en primovacunación) independientemente de la vacuna utilizada en la primovacunación. A fecha de redacción de este artículo los grupos en los que se recomienda la administración de una dosis de recuerdo son: personas de 60 o más años, personas que recibieron 1 dosis de la vacuna de Janssen, personal sanitario y sociosanitario, personas internas en centros de mayores y centros sociosanitarios y sanitarios diferentes a centros de mayores(8,9).
Inmunogenicidad, seguridad y reactogenicidad de la primovacunación heteróloga frente a la COVID-19: incluyendo vacunas de ARNm, vector viral y proteína recombinante adyuvada en el Reino Unido (Com-CoV2): un ensayo de fase 2, aleatorizado de no inferioridad, de simple ciego(10)
El estudio Com-COV2, prueba la immunogenicidad y seguridad de 6 pautas diferentes de vacunación, en 1.072 voluntarios sanos de 50 años o mayores, sin historia de infección previa confirmada por SARS-CoV-2 (seronegativos en el momento del reclutamiento), que han recibido como primera dosis Vazxevria o Comirnaty (de acuerdo con el programa de vacunación del Reino Unido) entre 8-12 semanas antes de ser incluidos en el estudio. Además, se excluyeron personas con comorbilidades consideradas severas o difíciles de controlar, con alergias o reacción anafiláctica previa a algún componente de la vacuna, mujeres embarazadas o que estén planificando un embarazo, mujeres lactantes y personas en tratamiento con anticoagulantes.
Una vez incluidos en el estudio a estos voluntarios se les administró de forma aleatoria como segunda dosis de la primovacunación: la misma vacuna que la primera dosis (pauta homóloga), Spikevax o la vacuna de Novavax. Esta última vacuna todavía no autorizada en el Reino Unido ni en la Unión Europea a fecha de redacción de este artículo. La tabla 1 resume las seis pautas de vacunación estudiadas en este estudio.
La no-inferioridad de la pauta heteróloga frente a la correspondiente pauta homóloga se alcanza si el límite inferior del IC 98,75% del cociente de la media geométrica (GMR, Geometric Mean Ratio) de las diferentes medidas de títulos de anticuerpos es superior al margen de no-inferioridad establecido (0,63).
El estudio incluye 1.072 voluntarios sanos (540 habían recibido Vazxzevria como primera dosis y 532 Comirnaty 9,4 semanas (de mediana) antes de ser reclutados en el ensayo. Las diferentes características basales (edad, sexo, etnicidad, comorbilidades) son similares entre los 3 grupos con la misma vacuna administrada en la primera dosis, excepto una mayor proporción de hombres en el grupo Comirnaty/Novavax.
Los resultados de inmunogenicidad (respuesta humoral y celular) se resumen en la tabla 2. La no inferioridad se alcanzó en todas las pautas heterólogas frente a la correspondiente homóloga salvo las obtenidas con la pauta heteróloga (Comirnaty/Novavax). Además, la seroconversion de títulos de anticuerpos IgG específicos frente a la proteína S del SARS-CoV-2 (ELISA), que se usó como medida principal de la respuesta humoral, fue estadísticamente superior a la obtenida con la pauta homóloga salvo con Comirnaty/Novavax. A pesar de no alcanzar la no inferioridad esta pauta sí que indujo un incremento de 18 veces (IC 95%: 15-21) comparado con los niveles basales en la media geométrica de la concentración (GMC, Geometric Mean Concentration) de IgG específica frente a la Proteína S de SARS-CoV-2 28 días después de la vacunación.
También se estudió la respuesta humoral con los títulos de anticuerpos neutralizantes con ensayos diferentes (como la prueba de neutralización por reducción de palcas PRNT entre otros) y se obtuvieron resultados similares como se observa en la tabla 2 a los obtenidos cuando se usaba como medida los títulos de anticuerpos IgG específicos frente a proteína S del SARS-CoV-2.
En cuanto a la respuesta celular (medida por EliSspot e Inferferon ɣ) es mayor en las pautas heterológas que en las correspondientes pautas homólogas salvo para Comirnaty/Novavax, al igual que lo observado en la respuesta humoral. La figura muestra la respuesta humoral y celular por tiempo desde la administración de la 2ª dosis, y se ve un aumento pronunciado en el día 7 que se mantiene estable en el día 28 (día de última medición en el ensayo clínico).
El perfil de seguridad de las diferentes pautas de vacunación, tanto heterólogas como la homóloga, es bueno como el ya conocido para cada una de las vacunas siendo la gran mayoría de las reacciones adversas reportadas leves. Se notificaron 15 reacciones adversas graves, pero ninguno se consideró relacionado por la vacunación. Se observó una mayor reactogenicidad en las pautas heterólogas con Spikevax comparada con las correspondientes pautas homólogas.
Tabla 1. Pautas de vacunación estudiadas en Com-COV2.
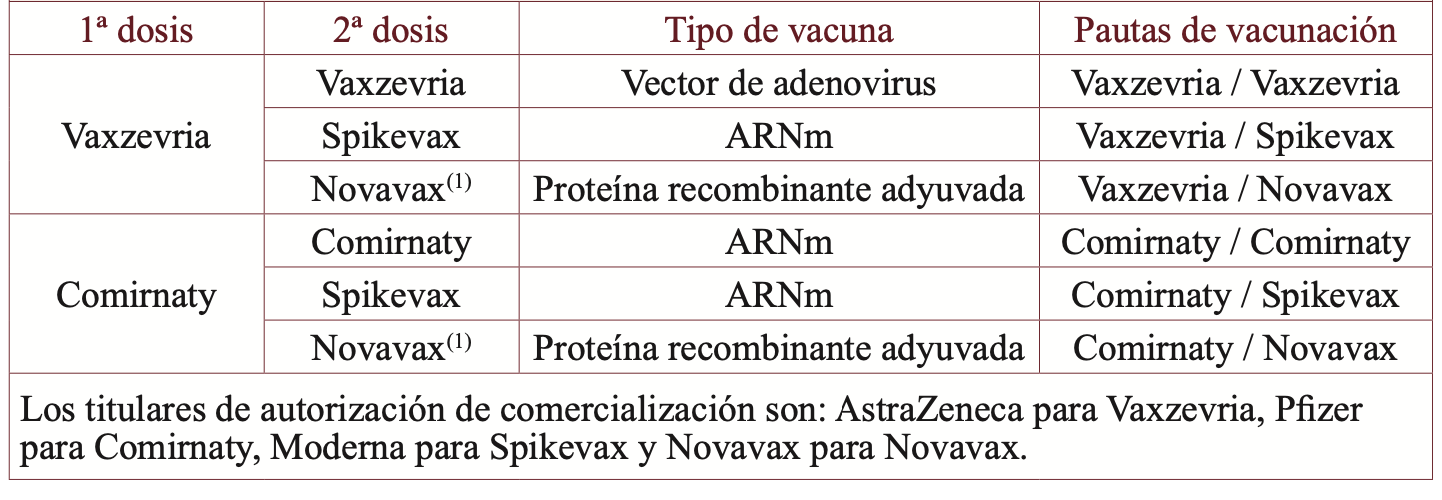
Tabla 2. Parte del resumen de los resultados de immunogenicidad entre pautas de primovacunación homólogas y heterólogas 28 días después de recibir la 2ª dosis.

En el análisis por protocolo, datos están en n/N, GMC (IC 95%) y GMP (IC 98,75%); en el análisis de intención de tratar modificado (mITT) los datos están en n/N, GMC (IC 95%) y GMR (IC 95%). BNT=vacuna BNT162b2, Pfizer–BioNTech [Comirnaty]. ChAd=vacuna ChAdOx1 nCoV-19, AstraZeneca [Vaxzevria]. ELU=Unidades de laboratorio ELISA, FRNT50=títulos de neutralización de reducción de foco al 50%, GMC=media geométrica de la concentración, GMR=cociente de la media geométrica m1273=vacuna mRNA−1273 vaccine, Moderna [Spikevax], NT80=título de anticuerpos neutralizantes al 80%, NVX=vacuna NVXCoV2373, Novavax [Novavax], NT50=título de anticuerpos neutralizantes al 50%, SFC=células formadoras de manchas, PBMC=célula mononuclear de sangre periférica.
(*) Las GMR se ajustaron por variables incluidas en la aleatorización estratificada, incluyendo el centro y la cohorte, con un IC 98,75% unilateral en los análisis por protocolo. En los análisis mITT además, se ajustaron por el intervalo entre el la primera y segunda dosis, la inmunogenicidad basal con un IC 95% bilateral. El margen de no inferioridad es 0,63.
(†) Una cepa relacionada con Wuhan aislada al principio de la pandemia en Australia.
(‡) Los datos de respuesta celular sólo estaban disponibles en alrededor de 60% de los centros, el resto de los centros del estudio no recogieron muestras de plasma debido a problemas logísticos.
Figura 1. Cinética de la inmunogenicidad por pauta de vacunación.

Los datos de respuesta celular sólo estaban disponibles en alrededor de 60% de los centros, el resto de los centros del estudio no recogieron muestras de plasma debido a problemas logísticos. Los datos presentados del día 7 y 14 son sólo de la ‘cohorte inmunológica’. Los datos presentados de los días 0 y 28 son de todos los participantes incluidos en el análisis de intención de tratar modificado (mITT). Los diagramas de caja muestran los percentiles 25, 50 (mediana) y 75. Los bigotes se extienden hasta el valor más grande dentro de 1,5 x el rango intercuartílico (IQR) por encima de la caja.
Panel A: títulos de anticuerpos IgG específicos frente a la proteína S del SARS-CoV2. Panel B: Respuesta celular (respuesta de células T).
BNT=vacuna BNT162b2, Pfizer–BioNTech [Comirnaty]. ChAd= vacuna ChAdOx1 nCoV-19, AstraZeneca [Vaxzevria]. ELU=Unidades de laboratorio ELISA, m1273=vacuna mRNA−1273 vaccine, Moderna [Spikevax], NVX=vacuna NVXCoV2373, Novavax [Novavax], SFC=células formadoras de manchas, PBMC=célula mononuclear de sangre periférica.
BIBLIOGRAFÍA:
- Borobia A, Carcas A, Pérez-Olmeda M et al. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet 2021; 398(10295): 121-130.
- Liu X, Shaw R, Stuart A et al. Safety and immunogenicity of heterologous versus homologous prime-boost schedules with an adenoviral vectored and mRNA COVID-19 vaccine (Com-COV): a single-blind, randomised, noninferiority trial. Lancet 2021; 398(10303): 856-869.
- Tenbusch T, Schumacher S, Vogel E et al. Heterologous prime–boost vaccination with ChAdOx1 nCoV-19 and BNT162b2. Lancet Infect Dis 2021; 21(9): 1212-1213.
- Schmidt T, Klemis V, Schub D et al. Immunogenicity and reactogenicity of heterologous ChAdOx1 nCoV19/mRNA Vaccination. Nat Medicine 2021; 27: 1530-1535.
- Benning L, Töllner M, Hidmark A et al. Heterologous ChAdOx1 nCoV-19/BNT162b2 Prime-Boost Vaccination Induces Strong Humoral Responses among Health Care Workers. Vaccines 2021; 9: 857.
- Barros-Martins J, Hammerschmidt S, Cossmann A et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination. Nat Medicine 2021; 27: 1525-1529.
- Dimeglio Ch, Herin F, Da-Silva I et al. Heterologous ChAdOx1-S/BNT162b2 vaccination: neutralizing antibody response to SARS-CoV-2. Clin Infect Dis published 12 August, 2021. https://doi.org/10.1093/cid/ciab705
-
Actualización 9 modificada de la Estrategia de vacunación frente a COVID-19 en España. Publicada el 2 de noviembre 2021. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/docs/COVID-19_Actualizacion9_Modificada_EstrategiaVacunacion.pdf

-
Recomendaciones de administración de dosis de recuerdo frente a COVID-19. Aprobado por la Comisión de Salud Pública, el 23 de noviembre de 2021: Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/docs/COVID-19_Actualizacion9_Modificada_EstrategiaVacunacion.pdf

- Stuart ASV, Shaw RH, Liu X et al. Immunogenicity, safety, and reactogenicity of heterologous COVID-19 primary vaccination incorporating mRNA, viral-vector, and protein-adjuvant vaccines in the UK (Com-COV2): a single-blind, randomised, phase 2, non-inferiority trial. Lancet. 2021 Dec 6: S0140-6736(21)02718-5.
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador