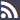Desarrollo de vacunas
Autores:
Esteban Aznar Cano.
Especialista en Microbiología y Parasitología y Médico Titular.
Lucía García San Miguel Rodríguez Alarcón.
Centro de Coordinación de Alertas y Emergencias Sanitarias, Ministerio de Sanidad.
Agustín Portela Moreira.
Jefe del Servicio de Biotecnología, Departamento de Medicamentos de Uso Humano de la AEMPS.
En este momento hay unas 250 vacunas candidatas frente a SARS-CoV-2 en desarrollo a nivel mundial. Entre ellas hay vacunas RNA, vectorizadas por virus replicantes y no replicantes, DNA, basadas en células dentríticas autólogas y de virus inactivados. Las vacunas candidatas según el Lanscape de la Organización Mundial de la Salud (OMS) a 20 de agosto son 30 en fase clínica y 139 en fase preclínica. Se incluyen vacunas RNA, DNA, virus inactivados, virus vivos atenuados, vectorizados por virus replicantes y no replicantes, de subunidades proteicas y de partículas similares a virus (VLP). Se han publicado resultados de cinco ensayos, que brevemente se resumen a continuación.
Inmunogenicidad y seguridad de una vacuna COVID-19 con un vector de adenovirus de tipo 5 recombinante en adultos sanos de 18 años o mayores: un ensayo de fase 2 aleatorizado, a doble ciego, controlado con placebo(1)
Se publica en Lancet los resultados de la fase 2 del ensayo de la vacuna de la compañía china CanSino. Esta vacuna expresa la proteína S del Virus SARS-CoV-2 y está diseñada utilizando un adenovirus humano (tipo 5) como vector. Se ensaya en 603 voluntarios sanos (18 a más de 55 años) en una administración a dosis única bien de 5 × 1010 o de 1 × 1011 partículas virales, frente a placebo. Los resultados de inmunogenicidad muestran una seroconversión importante de anticuerpos medidos por ELISA a los 28 días en prácticamente todos los participantes (96% y 97% en los grupos de 5 × 1010 y 1 × 1011 partículas virales), mientras que la detección de anticuerpos neutralizantes es relativamente baja (59% y 47% en los dos grupos, respectivamente). Los mayores de 55 años y las personas con altos niveles de anticuerpos neutralizantes frente a adenovirus de tipo 5 (52% de los participantes) tienen una respuesta significativamente menor. La inmunidad preexistente frente a adenovirus de tipo 5 (del que se deriva el vector adenoviral de esta vacuna) se considera el principal obstáculo de esta vacuna, pero los autores creen, por la experiencia con la vacuna del Ébola, que una segunda dosis administrada a los 3-6 meses de la primera aumentará mucho la respuesta. Además de los resultados observados en la inducción de anticuerpos neutralizantes, se observa una respuesta de células T importante (90% y 88%) en ambos grupos, lo que indica que la vacuna induce también inmunidad celular, si bien se desconoce el papel que esta inmunidad jugará en la protección frente a la enfermedad clínica.
El perfil de seguridad de la vacuna es bueno. Tras la administración de la vacuna se produjeron efectos secundarios esperados, mayoritariamente de carácter leves en el 72% y 74% de los participantes de ambos grupos. Los efectos graves ocurrieron en un 9% y 1%, siendo el más frecuente la aparición de fiebre, y todas estas reacciones se resolvieron en 3-4 días sin necesitar medicación. No se produjo ningún efecto considerado muy grave.
Seguridad e inmunogenicidad de la vacuna ChAdOx1 nCoV-19 contra el SARS-CoV-2: un informe preliminar de un ensayo controlado aleatorio, simple ciego, de fase ½(2)
Se ensaya en un grupo de 1.077 personas sanas de 18 a 55 años una vacuna que expresa la proteína S del Virus SARS-CoV-2 basada en un adenovirus de chimpancé (ChAdOx1 nCoV-19), usando como control otra vacuna frente a meningococo ACWY (MenACWY). Se prueban además en un subgrupo 4 técnicas diferentes de laboratorio para la detección de anticuerpos neutralizantes y su correlación con la detección de anticuerpos frente a la proteína S del virus mediante ELISA estandarizado. Se administra una sola dosis de 5 × 1010 partículas víricas, excepto a un grupo de 10 personas a las que se administra una segunda dosis a los 28 días de la primera. Se resumen los resultados de inmunogenicidad en las figuras 1 y 2. Los resultados de las diferentes técnicas de medida de la capacidad de neutralización muestran resultados diferentes para las mismas muestras, que varían entre el 62% y el 100% de seroconversión, poniéndose de manifiesto la necesidad de realizar técnicas estandarizadas para poder valorar de forma adecuada la eficacia de las vacunas. Como se ve en la figura 1, a 10 sujetos se les administró una segunda dosis de vacuna a los 28 días, y claramente los títulos neutralizantes aumentaron a los días 35 y 42. Este resultado hace pensar que sea necesario un régimen de dos dosis para obtener una adecuada respuesta de anticuerpos neutralizantes. También se observa en la figura que en estos 10 sujetos se alcanzan unos títulos de anticuerpos neutralizantes en el mismo orden de los que se observan en sueros de convalecientes. Los efectos adversos en general son los esperables, leves y autolimitados, sobre todo dolor y sensibilidad en el lugar de inyección; en el grupo de MenACWY y los tratados con paracetamol estos efectos son menores. No se produjo ningún efecto adverso muy grave o inesperado en ChAdOx1 nCoV-19, y sí en MenACWY (anemia hemolítica).
Figura 1. Anticuerpos neutralizantes tras la vacunación con ChAdOx1 nCoV-19 frente a vacunación con vacuna MenACWY, comparado con grupo control vacunado con dos dosis de ChAdOx1 nCoV-19 y una muestra de plasma de convalecientes.
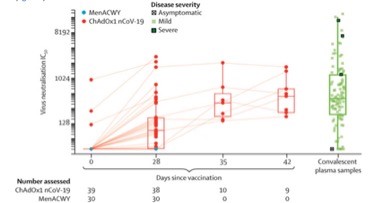
Figura 2. Respuesta celular (Inferferon ɣ y ELISspot) con vacuna MenACWY, ChAdOx1 nCoV-19 (1 dosis) y ChAdOx1 nCoV-19 (2 dosis).
Una vacuna de ARNm contra el SARS-CoV-2 - Informe preliminar.
Vacuna RNA de la compañía Moderna de EEUU. Ensayo en fase 1 con 45 individuos sanos.
Los resultados de seguridad se resumen en la tabla y los de inmunogenicidad en la figura 3.
Figura 3. Respuesta de anticuerpos y anticuerpos neutralizantes frente a SARS-CoV-2 tras la administración de la vacuna.

Los paneles A y B muestran la media, el rango intercuartílico y los valores máximos y mínimos de los títulos de anticuerpos IgG detectados mediante ELISA frente a la proteína S (panel A) y el dominio de unión al receptor del virus (panel B) en los días sucesivos de la administración de la vacuna a tres dosis crecientes y comparado con suero de 41 convalecientes. Los paneles C y D muestran los títulos de anticuerpos neutralizantes con dos ensayos diferentes: PsVNA (panel C) y PRNT80 (panel D).
Impacto de una vacuna inactivada contra el SARS-CoV-2 respecto a los resultados de seguridad e inmunogenicidad.
Se publican resultados provisionales de los ensayos aleatorizados y doble ciegos en fase 1 y fase 2 de un candidato a vacuna de virus inactivados completos.
En fase 1, 96 participantes fueron clasificados en cuatro grupos, tres según la dosis (2,5, 5 y 10 μg/dosis) y un grupo placebo en el que se utilizó sólo adyuvante. Todos recibieron tres dosis (0, 28 y 56 días). En fase 2, 224 participantes recibieron 5 μg/dosis frente a sólo adyuvante en dos posibles pautas: 0 y 14 días o 0 y 21 días.
Como medida de la inmunogenicidad se establecieron los títulos de anticuerpos neutralizantes (mediante prueba de neutralización por reducción de placas, PRNT) y los títulos de anticuerpos IgG específicos frente a SARS-CoV-2 (ELISA).
Los efectos secundarios observados a los siete días fueron leves (dolor y fiebre autolimitados los más fecuentes). No se observó ningún efecto adverso grave.
En la fase 1, la media geométrica de los títulos de anticuerpos neutralizantes el día 14 tras la tercera dosis fueron 316 (IC 95%, 218-457) en el grupo de dosis baja, 206 (IC 95%, 125-343) en el grupo de dosis intermedia y 297 (IC 95%, 208-424) en el grupo de dosis alta. En la fase 2, las medias geométricas de los títulos fueron 121 (IC 95%, 95-154) en el grupo que recibió inyecciones en los días 0 y 14 y 247 (IC 95%, 176-345) en el grupo que recibió las inyecciones en los días 0 y 21.
Los títulos de anticuerpos neutralizantes y de anticuerpos IgG específicos frente a SARS Cov 2 medidos en distintos puntos a lo largo del ensayo se observan en la figura 4 (fase 1) y en la figura 5 (fase 2).
Figura 4.

Los puntos representan los valores de los participantes individuales. Los diagramas de caja muestran los percentiles 25, 50 (mediana) y 75. Los bigotes se extienden a los valores adyacentes superior e inferior, los valores más lejanos dentro de 1,5 × el rango intercuartílico más allá de los percentiles 25 y 75. Los números debajo de los recuadros indican el número de participantes con el valor medible más bajo. Alum indica hidróxido de aluminio; SARS-CoV-2, coronavirus del síndrome respiratorio agudo severo 2.
Figura 5.
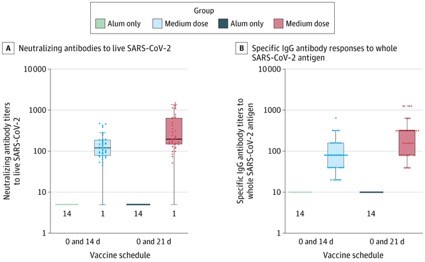
No se muestra la prevacunación; hubo 14 participantes en ambos grupos de hidróxido de aluminio y 42 en ambos grupos de vacunas de dosis media. No se pudieron detectar respuestas de anticuerpos medibles en la línea de base y, por lo tanto, los valores de línea de base fueron todos imputados por el límite inferior de detección de los ensayos, que fue 5 para la medición de anticuerpos neutralizantes y 10 para la medición de anticuerpos de unión a IgG específicos. Los puntos representan los valores de los participantes individuales. Los diagramas de caja muestran los percentiles 25, 50 (mediana) y 75. Los bigotes se extienden a los valores adyacentes superior e inferior, los valores más lejanos dentro de 1,5 × el rango intercuartílico más allá de los percentiles 25 y 75. Los números debajo de los recuadros indican el número de participantes con el valor medible más bajo. Solo la mitad de los participantes en el ensayo de fase 2 estaban programados para la medición de la inmunogenicidad humoral el día 14 después de la segunda inyección. SARS-CoV-2 indica coronavirus del síndrome respiratorio agudo grave 2.
Estudio de fase ½ de la vacuna de ARN COVID-19 BNT162b1 en adultos.
Ensayo aleatorizado y doble ciego. 45 participantes repartidos de manera aleatoria en tres grupos inmunizados con dos dosis (días 1 y 21) de 10, 30 y 100 μg respectivamente (en el grupo de 100 μg no se llegó a administrar la segunda dosis, dado que se observó una mayor frecuencia de efectos secundarios respecto al de 30 μg, sin aparente mejoría en la inmunogenicidad).
La vacuna es una molécula de mRNA con nucleósidos modificados vehiculizada en una nanopartícula lipídica que codifica para la región RBD de la proteína S de SARS-CoV-2. Los efectos adversos fueron frecuentes y dosis dependientes y, en su mayoría, leves o moderados. Los más frecuentes fueron dolor en el lugar de la inyección, fatiga, dolor de cabeza y fiebre. La Media geométrica de concentración de IgG específica estuvo entre 534 y 1.778 U/mL (602 U/mL en sueros de pacientes convalecientes) tras la primera dosis. Tras la segunda dosis, entre 4.813 y 27.872 U/mL. La media geométrica de los títulos de anticuerpos neutralizantes 14 días tras la segunda dosis en los grupos de 10 y 30 μg fueron 180 y 437 respectivamente (94 en sueros de pacientes convalecientes). En el grupo que recibió una sola dosis de 100 μg no se observó un aumento en la concentración de anticuerpos específicos a los 21 días respecto a la observada a los 7 días.
En la figura 6 se resumen los resultados de inmunogenicidad.
Figura 6.
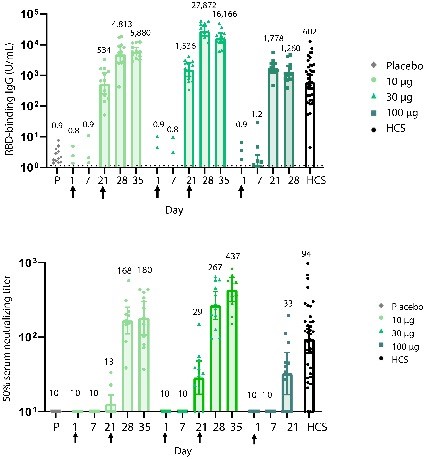
Los participantes en grupos de 15 fueron vacunados con los niveles de dosis indicados de BNT162b1 (n=12) o con placebo (n=3) en los días 1 (todos los niveles de dosis y placebo) y 21 (niveles de dosis de 10 μg y 30 μg y placebo). Las respuestas en los receptores de placebo para cada uno de los grupos de dosificación están combinadas. La extracción de sangre a los 28 días es 7 días después de la segunda vacunación. Los sueros fueron obtenidos antes de la vacunación (día 1) y 7, 21 y 28 días después de la primera vacunación. Se obtuvieron sueros de pacientes convalecientes de COVID-19 (HCS, n=38) al menos 14 días después del diagnóstico confirmado por PCR encontrándose los donantes asintomáticos. A) Media geométrica de la concentración (GMC) de IgG frente a RBD recombinante. Como las concentraciones medidas en Luminex están en unidades arbitrarias, no pueden traducirse directamente en concentraciones sobre una base molar o de masa. El límite inferior de la cuantificación es 1,15. B) 50% de las medias geométricas de los títulos (GMT) neutralizantes del SARS-CoV-2. Cada punto de datos representa una muestra de suero y cada barra vertical representa una media geométrica con IC 95%. El número encima de las barras es la GMC o GMT para el grupo. Las flechas indican el momento de la vacunación (se realizaron extracciones de sangre antes de la vacunación en los días de vacunación).
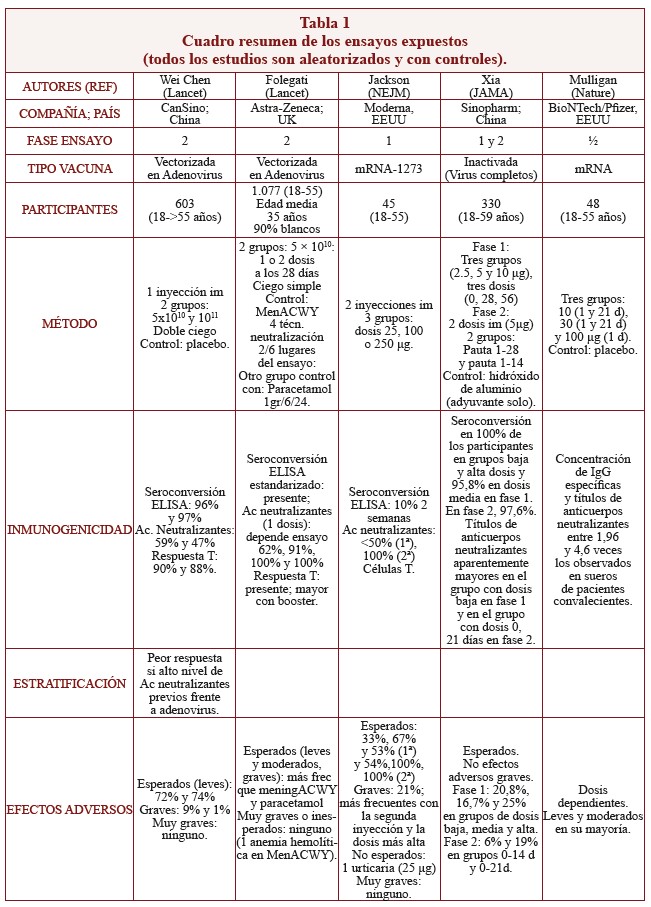
Tabla 1. Cuadro resumen de los ensayos expuestos.
BIBLIOGRAFÍA:
- The Lancet. Feng-Cai Zhu et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. 15.08.2020. Disponible en: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31605-6/fulltext
- The Lancet. Pedro M Folegatti et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. 15.08.2020. Disponible en: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31604-4/fulltext
- NEJM. Lisa A Jackson et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. 14.07.2020. Disponible en: https://www.nejm.org/doi/full/10.1056/NEJMoa2022483
- JAMA. Shengli Xia et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes. 13.08.2020. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2769612
- Nature. Mark J. Mulligan et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. 13.08.2020. Disponible en: https://www.nature.com/articles/s41586-020-2639-4
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador